Defeito do septo Interventricular
- Bruno Holz

- 31 de out. de 2022
- 6 min de leitura
Os defeitos do septo ventricular (CIV) são os defeitos cardíacos congênitos mais comuns, representando 25 a 30 por cento de todas as cardiopatias congênitas. No entanto, a maioria são pequenos defeitos que fecham espontaneamente ou não têm significado clínico. As implicações clínicas dependem:
-Tamanho,
-Localização no septo ventricular.
Ocorrem como lesões isoladas ou em combinação com outras anomalias. Eles são o defeito cardíaco mais comum encontrado em anomalias cromossômicas como trissomias 13, 18 e 21 e deleção 22q11.
Morfologia
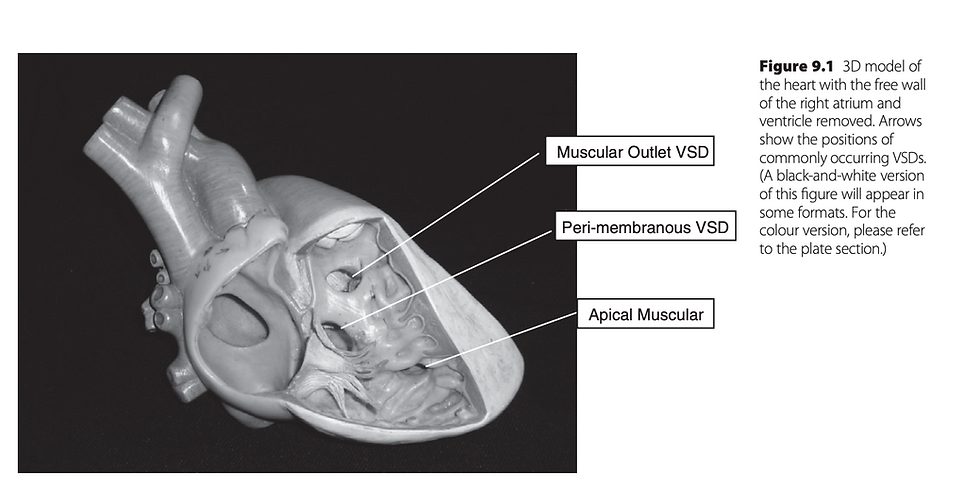
Do ponto de vista cirúrgico, a localização de um CIV é importante, pois define a abordagem para fechá-lo e alerta o cirurgião quanto à localização das fibras de condução que podem ser danificadas ao fechar o CIV. Vamos dividir em 3: Peri-membranosa, justa-arterial ou duplamente relacionada e muscular.
Perimembranosa
CIV encontra-se entre as valvas tricúspide e aórtica. Os feixes de condução correm ao longo da borda postero-inferior do defeito. Eles podem ser:
-CIV de entrada,
-saída
-entrada-saída.
Eles representam cerca de 80 por cento das CIVs que exigem fechamento cirúrgico em algumas séries. Podem causar insuficiência valvar aórtica secundária ao prolapso de cúspide direita ou não coronariana para o defeito. (Eles também são chamados de 'infracristais' ou 'membranosos'.)
Justa-arterial ou duplamente relacionada
São formados na junção da valva aórtica e pulmonar. Os feixes de condução estão distantes do defeito. (Eles também são chamados de 'supracristais', 'conal' ou 'infundibular'.) Eles também podem causar insuficiência aórtica por prolapso da cúspide coronária direita. Eles constituem cerca de 5 por cento dos CIV vistos no Ocidente, mas são mais comuns nos países asiáticos. Não fecham espontaneamente.
Musculares
Estes são os tipos mais comuns de CIV e os que mais fecham espontaneamente. As bordas da CIV são inteiramente musculares, podendo ocorrer em qualquer ponto do septo ventricular, sendo descritas por sua posição como defeitos de entrada, apicotrabecular ou de saída. Eles podem ser múltiplos. Os feixes de condução estão distantes do defeito e, no caso do CIV de entrada, passam próximo à margem superior do defeito. Defeitos maiores podem exigir fechamento cirúrgico, representando 5 a 10 por cento dos CIVs fechados cirurgicamente.
Fisiopatologia e historia natural
Defeito restritivo: Pequenos defeitos apresentando resistência ao fluxo através do defeito, com relação fluxo pulmonar-sistêmico Qp:Qs < 1,5.
Defeito não restritivo: Isso ocorre quando a área de secção transversal do defeito é equivalente ou maior que a do anel aórtico. Não há resistência ao fluxo através do defeito, as pressões ventriculares direita e esquerda aproximam-se da paridade e o Qp:Qs é inversamente proporcional à razão das resistências vasculares pulmonares-sistêmicas.
Consequências hemodinâmicas de um defeito não restritivo: A magnitude e a direção do desvio através do defeito dependem do tamanho do defeito e da complacência do leito vascular distal. O shunt da esquerda para a direita causa aumento do fluxo sanguíneo pulmonar ('sobrecirculação pulmonar') e sobrecarga de volume do ventrículo esquerdo levando à insuficiência cardíaca congestiva.
Recém-nascidos e lactentes com defeitos irrestritos apresentam insuficiência cardíaca e requerem reparo urgente; se não tratada, a sobrevida em um ano é de apenas 10%. No outro extremo do espectro, pequenos defeitos restritivos não têm significado hemodinâmico e não causam sintomas na grande maioria das vezes. Defeitos maiores que escapam à detecção podem levar a hipertensão pulmonar irreversível e doença vascular pulmonar a longo prazo. Em pacientes não tratados, a resistência vascular pulmonar elevada e as altas pressões do lado direito podem levar à reversão do shunt e cianose em cerca de 10% desses pacientes na terceira e quarta décadas (síndrome de Eisenmenger).
Apresentação
Defeitos maiores se apresentam na infância com insuficiência cardíaca congestiva, infecções recorrentes no tórax, déficit de crescimento e falta de ar.
Um Qp:Qs > 2 é mal tolerado. Os sintomas geralmente começam quando a resistência vascular pulmonar cai nas quatro a seis semanas após o nascimento – os bebês podem ficar suados e taquipnéicos durante as mamadas, incapazes de terminar volumes adequados de alimentação e não ganhar peso adequado.
Defeitos menores podem ser totalmente assintomáticos. A endocardite infecciosa é um risco de CIV. CIVs subarteriais duplamente comprometidas (DCSA) e perimembranosas de saída podem apresentar regurgitação aórtica, com a cúspide coronária direita.
O ECG pode ser normal, mas defeitos maiores podem mostrar hipertrofia ventricular esquerda e direita. O desvio do eixo inferior é visto em alguns CIVs de entrada.
A radiografia torácica mostra cardiomegalia e marcações vasculares aumentadas. A ecocardiografia é a investigação definitiva e diagnóstica, define a localização e o tamanho do defeito, a extensão das consequências hemodinâmicas e anomalias associadas.
O cateterismo cardíaco não é necessário para a investigação de rotina de CIV em lactentes. Em crianças com mais de um ano de idade com CIV moderado ou irrestrito, pode ser necessário cateterismo cardíaco para investigar a resistência vascular pulmonar e a adequação do fechamento da CIV.
A resistência vascular pulmonar (RVP) de 2 a 4 unidades de Wood indexadas pode ser considerada normal. Se a RVP for de 4 a 8 unidades de Wood indexadas, mas reversível com vasodilatação pulmonar, a cirurgia pode ser realizada. Se a RVP for maior que 8 unidades Wood e irreversível com oxigênio suplementar e óxido nítrico, a doença vascular pulmonar está estabelecida e irreversível – o fechamento da CIV não altera a história natural e pode levar a pressões ventriculares direitas mais altas e insuficiência ventricular direita .
Fechamento de CIV
Segue abaixo uma tabela mostrando as indicações de fechamento de CIV.

Fechamento percutâneo: Alguns CIVs podem ser fechados por dispositivos colocados percutaneamente – estes são usados principalmente para fechar defeitos musculares, particularmente defeitos apicais que são inacessíveis ao cirurgião. No entanto, isso é principalmente restrito a crianças mais velhas, pois o acesso vascular adequado não é possível em bebês menores. Alguns defeitos perimembranosos menores também podem ser fechados dessa forma, mas a proximidade da valva aórtica e a ausência de uma 'margem' superiormente para assentar o dispositivo limitam a aplicação – há também o risco de bloqueio do nó A-V e regurgitação aórtica ( ~5 por cento) e regurgitação tricúspide (~10 por cento).
Fechamento Cirúrgico: A abordagem padrão em lactentes e crianças pequenas é através de esternotomia mediana com canulação bicaval, hipotermia moderada e parada cardioplégica. A maioria é abordada pelo átrio direito, trabalhando através da valva tricúspide (“reparo transatrial”).
Defeitos Perimembranosos: Estes são abordados através de uma atriotomia direita. O folheto septal da valva tricúspide pode ter que ser retraído suavemente ou até mesmo destacado para exposição da CIV. O pericárdio bovino preservado com Gore-Tex, Dacron ou glutaraldeído é usado para fechar o defeito; mesmo pequenos defeitos devem ser fechados com um remendo. Deve-se ter cuidado para evitar que o tecido de condução passe pela margem póstero-inferior da CIV. Os remendos podem ser colocados com suturas contínuas ou interrompidas.
Defeitos musculares de entrada e trabeculares: são abordados através do átrio direito. Defeitos musculares trabeculares apicais podem precisar ser abordados através de uma ventriculotomia direita. Defeitos moderados a grandes devem ser fechados com um remendo, mas defeitos menores podem ser fechados com suturas reforçadas. Tome cuidado para evitar que os feixes de condução passem pelas margens superiores dos CIVs de entrada.
Defeitos Sub-arteriais Duplamente Comprometidos (DCSA): Estes são mais facilmente abordados através de uma arteriotomia pulmonar, através da valva pulmonar, com algumas suturas ancorando o retalho através da base dos folhetos da valva pulmonar. O eixo de condução está distante das margens. Se houver regurgitação aórtica leve associada, não precisa mexer na valva, mas se a regurgitação for moderada, deve-se tentar o reparo da valva aórtica, plicando ou ressuspendindo o folheto prolapsante.
Algumas vezes não há como corrigir o defeito do septo, por alguns motivos, por isso opta-se, em um primeiro momento, de se bandar a artéria pulmonar para evitar hiperfluxo pulmonar. Abaixo segue indicações para bandagem da artéria pulmonar

Complicações
A mortalidade é inferior a 1 por cento em CIV isolada, mas pode ser maior em defeitos múltiplos ou quando associada a outras lesões. CIVs residuais podem ocorrer devido ao fechamento incompleto ou aos pontos rasgando o septo sob tensão. Estes podem precisar de reintervenção se Qp:Qs > 1,5:1.
Distúrbio de condução: O bloqueio do ramo direito (BRD) é quase sempre observado após o fechamento da CIV perimembranosa, mas o bloqueio cardíaco completo ocorre em apenas 1%. A longo prazo, até 4% dos CIVs reparados podem desenvolver a síndrome do nódulo sinusal.
Antibióticos profiláticos (para cobrir um procedimento invasivo ou trabalho odontológico) são recomendados apenas nos primeiros seis meses após a cirurgia. A regurgitação valvar aórtica e tricúspide pode ocorrer se essas estruturas forem danificadas durante o fechamento, reforçando a importância da realização de eco intraoperatório para excluir esses problemas.
Follow-up
Todas as crianças devem ser acompanhadas para garantir o retorno das dimensões ventriculares normais e excluir lesões residuais ou desenvolvimento de regurgitação aórtica. As crianças que não têm problemas residuais podem ser dispensadas.
Referência Bibliofráfica
Core Topics in Congenital Cardiac Surgery; Edited By David J. Barrin; Página 40-43.
Corone P, Doyon F, Gaudeau S et al. Natural history of ventricular septal defect: a study involving 790 cases. Circulation 1977; 55(6): 908–15.
Predescu D, Chaturvedi RR, Friedberg MK et al. Complete heart block associated with device closure of perimembranous ventricular septal defects. J Thorac Cardiovasc Surg 2008; 136(5): 1223–28.
Yip WC, Zimmerman F, Hijazi ZM. Heart block and empirical therapy after transcatheter closure of perimembranous ventricular septal defect. Cathet Cardiovasc Intervent 2005; 66(3): 436–41.










































Comentários